Введение
Наиболее популярные склерозанты, такие как тетрадецилсульфат натрия (ФИБРО-ВЕЙН, STS) и полидоканол (Этоксисклерол, POL), относятся к детергентам. В процессе склеротерапии их вводят в варикозную вену чтобы удалить интиму, вызвать фиброз и окклюзию вены. Действующие вещества склерозантов - это поверхностно активные молекулы (сурфактанты), которые разрушают фосфолипидную мембрану клеток, вызывая их распад.
Склерозанты действуют на клетки-мишени по разному, в зависимости от концентрации. Если высокие концентрации вызывают разрушение клеток, то низкие концентрации активируют клетки и высвобождают прокоагулянты, инициирующие тромбоз. Это свойство обусловлено способностью склерозантов взаимодействовать с фосфолипидами мембран. Кроме того, ионные поверхностно-активные молекулы могут взаимодействовать с белками плазмы и клеточных мембран.
Физико-химические свойства склерозантов определяют характер их взаимодействия с клетками-мишенями и предопределяют клинический эффект лечения.
Детергенты и сурфактанты
Оба склерозанта STS и POL относятся к поверхностно активным детергентам. Детергенты, или попросту моющие средства, используют в промышленности и в быту для очистки. Воду и мыло также можно отнести к детергентам. Детергентами могут быть разные соединения: размягчители, абразивы, отбеливатели, буферы, пенно-модифицирующие вещества, и, наконец, поверхностно активные вещества (ПАВ) или сурфактанты.
Слово сурфактант означает поверхностно активное вещество или ПАВ (Surface active agent = surfactant). ПАВ уменьшают поверхностное натяжение жидкости, которое измеряется отношением силы на единицу длины (=N/м). Поверхностное натяжение отражает силу сцепления молекул, образующих пленку на поверхности жидкости. Например, поверхностное натяжение поддерживает форму капли жидкости. Если перемещать объект через поверхность жидкости, то придется преодолеть силу сцепления молекул и затратить больше усилий, чем при перемещении объекта в самой жидкости.
Мыло - это поверхностно активный детергент, состоящий из натриевых или калиевых солей жирных кислот.
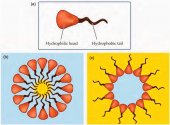 Сурфактанты являются амфифильными соединениями, имеющими гидрофобный (неполярный) хвост и гидрофильную (полярную) головку (рис. 1а). Таким образом, ПАВ растворимы как в масле (жире), так и в воде.
Сурфактанты являются амфифильными соединениями, имеющими гидрофобный (неполярный) хвост и гидрофильную (полярную) головку (рис. 1а). Таким образом, ПАВ растворимы как в масле (жире), так и в воде.
Сурфактанты снижают поверхностное натяжение путем абсорбции на границе раздела двух жидкостей. Если добавить в воду масло (жиры) оно не растворится, а образует взвешенные в воде капли. Присутствие ПАВ уменьшает поверхностное натяжение на границе двух сред, не давая маслу образовывать крупные капли. Таким образом, ПАВ разбивают масло на мельчайшие капли, которые затем могут быть смыты.
Это модель, демонстрирующая действие сурфактанов. ПАВ разбивают жир на мелкие капли, которые затем всплывают на поверхность жидкости. Это всего лишь модель, но вероятно, примерно также склерозант разрушает липидные мембраны эндотелия в просвете вены во время проведения склеротерапии.
Благодаря гидрофобным головкам, сурфактанты имитируют липиды клеточных мембран, однако будучи мономерами они не образуют двойной слой. Гидрофобные хвосты ПАВ придают им способность растворяться в воде. Когда ПАВ достигают определенной концентрации, они спонтанно формируют агрегаты - мицеллы. Такая концентрация называется критической мицеллярной концентрацией (КМК). Потдостижении КМКМ, мономеры и мицеллы сосуществуют в растворе в динамическом равновесии. КМК зависит от размера, заряда и длины молекулы сурфактанта, а также от буферных свойств соляного раствора. Для детергентов с одинаковой структурой головки, КМК снижается примерно на порядок с увеличением длины хвоста на каждые две метиленовые единицы. Любые буферные добавки значительно влияют на КМК, растворимость, агрегацию сурфактантов. Например, высокие концентрации солей значительно снижают КМК ионных детергентов.
Образование мицелл:
Когда мицеллы собираются в водной среде, гидрофильные (полярные или ионные) головки остаются в контакте с водой, в то время как гидрофобные хвосты образуют ядро, которое может окружать частички нерастворимых в воде веществ, таких как масло или жир. Это, так называемая, нормальная фаза или мицелла типа "масло в воде" (рис. 1b).
Такие мицеллы растворимы в воде. Они обмениваются молекулами ПАВ с другими мицеллами и мономерами ПАВ в растворе, находясь в динамическом равновесии.
Когда сурфактант добавляют в масло, образуются обратные мицеллы. Иначе их называют мицеллы типа "вода в масле". Неполярные головки таких мицелл контактируют с масляной средой, в то время как хвосты образуют ядро, в центре которого может быть капля воды (рис. 1с).
При определенной температуре, индивидуальной для каждого сурфактанта, образуется максимальное количество мицелл, в результате чего раствор мутнеет. Такая температура называется критической температурой мицеллообразования или, проще говоря, "точкой помутнения". Этот феномен больше характерен для не ионных сурфактантов.
Классификация ПАВ
Сурфактанты могут быть разделены на 4 группы в зависимости от поверхностного заряда. Не ионные ПАВ не содержат заряженных групп, анионные заряжены отрицательно, а катионные - положительно. STS - это анионный сурфактант, POL - не ионный.
ПАВ, головка которых содержит две противоположно заряженные группы называют цвитеррионными. Их гидрофильная головка на имеет заряда. Такие ПАВ являются амфотерными (способными взаимодействовать химически как кислоты и как основания) и амфолитическими (в кислых растворах они выступают катионами, а в щелочных - анионами).
Анионные ПАВ обычно содержат сульфатную, сульфонатную или карбоксилатную группы. STS содержит сульфатную группу. Не ионные ПАВ содержат высокомолекулярные (жирные) спирты или алкилполиэтиленоксиды такие как полисорбаты. POL является полиэтиленоксидным детергентом.
Склерозанты-детергенты
Склерозанты-детергенты повреждают эндотелиальную выстилку сосудов-мишеней с обнажением коллагеновых волокон базальной мембраны, что в последующем ведет к эндоваскулярному фиброзу. Чаще всего используются такие склерозанты как тетрадецилсульфат натрия (Фибровейн, STS) и полидоканол (Этоксисклерол, POL). Моруат натрия и этаноламина олеат используются гораздо реже. Клинически, STS считается по крайней мере в три раза сильнее POL.
Тетрадецилсульфат натрия (Фибровейн, STS)
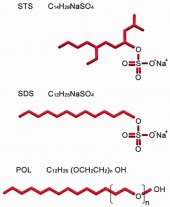
STS (C14H29NaSO4) является отрицательно заряженным сульфатным сурфактантом с молекулярной массой 316,44 г/моль (рисунок 2а). STS, распространяемый в России под брендом ФИБРО-ВЕЙН® изготовлен STD Pharmaceutical Products Ltd. (Hereford, UK). В Соединенных Штатах, препарат с коммерческим названием SOTRADECOL® производится Bioniche Teo. Inverin, Co. Galway, Ireland, дистрибьютер AngioDynamics, Queensbury, NY, USA.
КМК ФИБРО-ВЕЙНА составляет 0,075% в физиологическом растворе и 0,2% в воде. В каждом миллилитре 3% раствора содержится 30 мг STS и 2% бензилового спирта в качестве бактерицидного компонента, а также фосфаты калия, натрия и гидроксид натрия в качестве буферов. pH ФИБРО-ВЕЙНА составляет 7,6. SOTRADECOL® содержит те же компоненты, но его pH 7,9.
В клинической практике ФИБРО-ВЕЙН используется в следующих концентрациях:
0,05-0,2% - телеангиэктазы, венулэктазы
0,2-0,5% - ретикулярные вены
1-3% - варикозно расширенные вены
Для склерозирования варикозных вен, как правило, используется пена. Для лечения телеангиэктазов и ретикулярных вен - раствор.
STS дистиллируют из анионного сурфактанта Niaproof 4 (так же известного как NAS 4, Niacet) - концентрированного моющего средства. Этот детергент широко применяется в промышленности при производстве красителей, текстиля, бытовых и промышленных очистителей. Также он используется для протравливания (позволяет уменьшить количество кислоты), в литейном производстве (обеспечивает равномерное распределение в литейной форме). В фармацевтике Ниапруф 4 применяется для усиления бактерицидных свойств антисептиков и быстрой фиксации гистологических препаратов. При производстве латекса он выступает в качестве эмульгатора, обеспечивающего полимеризацию мономеров.
NAS 4 содержит 27% STS и 20% карбитола. Карбитол имеет профиль токсичности аналогичный этиленгликолю. Известны его мутагенные и тератогенные эффекты в экспериментах на бактериях и мышах, также он может вызвать острую или замедленную реакцию гиперчувствительности у человека. Поэтому NAS 4 нуждается в очистке для производства STS в форме инъекций. ФИБРО-ВЕЙН® содержит 0,02% до 0,045% карбитола.
STS по структуре схож с додецилсульфатом натрия (SDS), детергентом, использующемся в биохимии протеинов (рис. 2b), они обладают примерно одинаковыми свойствами. SDS - это сильный и резкий детергент, его используют когда нужно вызвать лизис клеток, а также для электрофореза полиакриламидного геля. Будучи анионным ПАВ, SDS - это мощный солюбилизатор, способный денатурировать большинство протеинов.
Реактивация SDS-солюбилизированных белков в некоторых случаях возможна. Протеины А-класса, входящие в состав наружной мембраны Грамм-отрицательных бактерий, устойчивы к действию SDS. SDS осаждается при низких температурах и в присутствии катионов.
Полидоканол (Этоксисклерол, POL)
Лауромакрогол 400 (C12H25O(CH2CH2O)nH, гидроксиполиэтоксидодекан, POL) - полиэтиленгликольэфир лаурилового спирта. Как склерозант POL доступен в нашей стране под брендом AETHOXYSKLEROL 0,5%, 1% и 3% (Chemische Fabrik Kreussler & Co GmbH, Wiesbaden, Germany). В США используется препарат того же производителя (дистрибьютор ASCLERA®). Недавно в США была зарегистрирована и стала доступной для клинического использования микро-пенная форма POL - 1% VARITHENA™ (BTG, Pennsylvania, USA).
КМК Полидаконола по данным производителя составляет примерно 0,084 г/л или 0,148 мм. В соляном растворе и в воде КМК POL одинакова и составляет 0,002%.
При концентрации 3%, в каждом миллилитре Этоксисклерола содержится 30 мг POL, растворенного в водном растворе 5% этанола. Раствор буферизирован фосфатами (гидрофосфатдегидрат натрия и дигидрофосфат калия) до pH 6,5-8,0.
Этоксисклерол используется в следующих концентрациях:
0,1-0,5% - для телеангиэктазов и ретикулярных вен
1-3% - для варикозных вен
POL - это не ионный эмульгатор, состоящий из дух компонентов: полярной гидрофильной головки (додецилсульфат) и не полярного гидрофобного хвоста (полиэтиленоксид) (рис. 2с). POL относится к группе алкилполигликольэфиров, которые обычно называют этоксилатами спиртов (ЭС). ЭС производят путем реакции естественных жирных или синтетических спиртов с этиленоксидом.
Эти детергенты имеют различную длину цепей (хвоста), могут использоваться как в виде смесей, так и в виде чистого вещества с одинаковой цепью. Их общая формула CxEy, обозначающая длину алкильной цепи (x) и числа полиоксиэтиленгликольных групп (y). POL, производимый Kreussler, имеет алкильную цепь, состоящую из 12 атомов углерода и 9 этиленоксидных единиц. Таким образом его формула выглядит так: C12E9. Молекулярная масса POL составляет около 600.
POL был впервые апробирован в Германии в 1936 году в качестве местного анестетика. Его анестезирующие свойства (характерные и для других ПАВ) были исследованы на добровольцах параллельно с другими местными анестетиками (Лидокаин и Прилокаин). По сравнению с ними, POL не оказывал существенного влияния на тепловую и холодовую чувствительность, не обладал он и значимым анестезирующим эффектом.
В косметической промышленности POL применяется под названием Laureth-9 (Лаурет-9). В качестве эмульгатора и ПАВ, Полидоканол используется в шампунях и кондиционерах в концентрации до 4%. Также он входит в состав некоторых кремов для лица и тела в концентрации до 3%.
Биологические клеточные мембраны
Клеточные мембраны представляют собой двойной слой липидов. Подобно ПАВ, мембранные фосфолипиды амфофильны, они содержат гидрофильную полярную головку и гидрофобный хвост. Фосфолипиды обычно содержат две углеводородные цепи, образующие хвост, а ПАВ могут иметь как одну, так и две таких цепи.
Молекулы с большими углеводородными хвостами, как правило, образуют двойные слои, поскольку они слишком громоздки чтобы вписаться в более мелкие структуры, такие как мицеллы. Таким образом, фосфолипиды с двумя углеводородными цепями (хвостами) образуют двойные слои, а более мелкие ПАВ склонны к образованию мицелл.
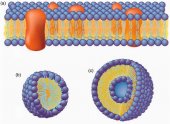
Полярные головки фосфолипидов обращены наружу по обе стороны двухслойной структуры (рис. 3а). Один слой полярных головок обращен во внешнюю среду (экзопластический слой), в то время как другой - контактирует с цитоплазмой (цитоплазматический слой). Углеводородные гидрофобные хвосты каждого слоя обращены друг к другу.
Мембранная структура достаточно податлива и поддерживается не за счет ковалентных связей, а за счет взаимодействия гидрофобных цепей. Это свойство мембран иначе называется жидкостность или текучесть - способность мембраны к латеральной диффузии липидов и протеинов. Разрушение клеточной мембраны приводит к образованию однослойных мицелл или двухслойных липосом (рис. 3 b, с). Фосфолипидные мицеллы имеют гидрофильную наружную поверхность и гидрофобную сердцевину. Липосомы имеют гидрофильную внешнюю и внутренние поверхности, внутри они могут содержать водный раствор.
Состав мембранных липидов
Наиболее распространенными фосфолипидами являются фосфатидилэтаноламин и фосфатидилхолин. Другие мембранные липиды включают гликолипиды и холестерин, но они встречаются реже. Клеточные мембраны поддерживают асимметричное распределение фосфолипидов на цитоплазматических и экзопластических поверхностях (трансмембранная асимметрия липидов). В состоянии покоя, цитоплазматическая (внутренняя) поверхность содержит больше анионов и аминов, включающих такие фосфолипиды как фосфатидилсерин (ФС) и фосфатидилэтаноламин. Экзопластическая (внешняя) поверхность богата холином и содержит такие фосфолипиды как фосфатидилхолин и сфингомиелин.
Асимметричное распределение фосфолипидов на клеточных мембранах строго контролируется и поддерживается группой ферментов называемых флип-пасами и флоп-пасами (flippases, floppases). Эти ферменты используют АТФ для переноса фосфолипидов по обе стороны мембраны. Транспорт анионных фосфолипидов в сторону цитоплазмы осуществляют флип-пасы, в то время флоп-пасы переносят фосфолипиды, содержащие холин на экзоплазматическую поверхность мембраны ("флип-флоп" перескоки). Таким образом, эти ферменты активно поддерживают трансмембранную асимметрию липидов в состоянии покоя.
Активация клетки или апоптоз сопровождается переносом отрицательно заряженных фосфолипидов, таких как ФС, на экзоплазматическую поверхность мембраны. Этот процесс осуществляется посредством других ферментов, называемых скрамблассами (scramblases). Эти ферменты АТФ-независимы. Они активируются при увеличении концентрации Са в цитоплазме. Скрамблассы перераспределяют отрицательно заряженные фосфолипиды симметрично по обе стороны мембраны.
Мембранные белки
Мембраны содержат различные белки. Существуют интегральные и периферийные мембранные протеины.
Интегральные мембранные белки выполняют функции рецепторов, адгезивов, транспортеров, каналов и постоянно находятся на поверхности мембран. Интегральные мембранные белки могут быть трансмембранными, когда они проходят через всю толщу мембрану или монотопическими, когда прикреплены только к одной стороне мембраны. Для того чтобы интегральные протеины высвободились необходим полный разрыв липидного бислоя мембраны, как это бывает при воздействии ПАВ.
Периферийные мембранные протеины прикрепляются к интегральным мембранным белкам или пенетрируют наружный слой липидов, прикрепляясь за счет не ковалентных связей. Для извлечения этих белков не требуется разрушения мембран, достаточно изменить свойства раствора, сделав его выско- или низко солевым, или изменив рН в сторону алкалоза.
Взаимодействие детергентов с клеточными мембранами
Поверхностно активные детергенты используют в производстве для растворения мембранных белков и липидов. В биохимии мембран относительно высокие концентрации детергентов с низким КМК используются для растворения больших количеств липидов. Удалить липиды также можно и с помощью органических растворителей, но эти агенты разрушают нативную структуру мембранных белков. Солюбилизация (растворение) с использованием ПАВ является более мягким методом, который не вызывает денатурацию протеинов.
Этапы солюбилизации (растворения) мембран
Солюбилизация биологических мембран представляет собой ряд последовательных, перекрывающихся фаз, которые определяется концентрацией свободных ПАВ (рис 4а). При увеличении концентрации ПАВ в растворе, липидный бислой постепенно разрушается, фрагментируется и, в конечном итоге, растворяется.
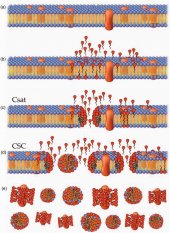 Первый этап: начальная фаза или не кооперативное взаимодействие. При низких концентрациях ПАВ-мономеры включаются в липидный бислой, не нарушая структуру мембраны (рис 4б).
Первый этап: начальная фаза или не кооперативное взаимодействие. При низких концентрациях ПАВ-мономеры включаются в липидный бислой, не нарушая структуру мембраны (рис 4б).
Второй этап: кооперативное взаимодействие и сатурация (насыщение). После достижения определенной «критической концентрации насыщения» (ККН, critical saturation concentration - CSAT), ПАВ-мономеры кооперируются, образуют агрегаты внутри мембраны, создавая небольшие фрагменты. Эти сегменты мембраны имеют тороидальную форму, напоминающую пончик (doughnut-shaped). Эти комплексы-пончики отгорожены от внешней среды ПАВ-мономерами, которые покрывают пончик словно пудра (рис. 4с).
Третий этап: солюбилизация (растворение). Когда концентрация ПАВ достигает 'критической концентрации солюбилизации' (critical solubilisation concentration’ - CSC), двухслойная мембрана разрушается с образованием смешанных липидно-сурфактантных мицелл и небольших свободных листков мембран (рис. 4d).
Заключительный этап: На этой стадии в растворе присутствуют только смешанные липидно-сурфактантные мицеллы и покрытые сурфактантом фрагменты мембран (Рис 4е). Поверхностно-активные вещества также взаимодействуют с гидрофобными участками мембранных белков и, по сути, заменяют липиды.
Факторы, влияющие на взаимодействие склерозантов и клеточных мембран
ПАВ могут образовывать смешанные мицеллы с липидами, связываться с гидрофобными участками белков и вызвать их денатурацию. Анионные и не-ионные детергенты могут связывать сывороточный альбумин своими гидрофобными цепями. Конечный результат взаимодействия ПАВ с клеточными мембранами зависит от физических и химических характеристик, таких как заряд, КМК и величина агрегации.
В общем, ПАВ с нейтрально заряженной крупной головкой и более длинной хвостовой углеводородной цепью (такие, как POL) действуют мягко. ПАВ с полярной, небольшой головной группой и короткой алкильной цепью (такие, как STS) действуют жестче и чаще денатурируют белок и разрушают мембранные белковые комплексы. Воздействие на мембранные белки также обусловлено ионной природой полярный головки молекулы STS. Не-ионные детергенты (например, POL) солюбилизируют мембранные белки, не затрагивая важных структур.
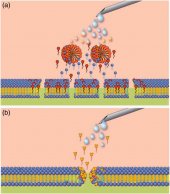
Солюбилизация мембран: анионные поверхностно-активные вещества, такие как додецилсульфат натрия (SDS) или тетрадецилсульфат натрия (STS), могут солюбилизировать (растворять) мембраны путем экстракции фосфолипидных молекул непосредственно из мембраны в заранее собранную мицеллу (рис. 5а). Неионные детергенты, такие как полидоканола (POL), с большей вероятностью образуют тороидальные комплексы (рис. 5b).
Не-ионные ПАВ считаются «мягкими детергентами», не вызывающими денатурации белков. Можно сказать, что не-ионные ПАВ с углеводородными цепями средней средней длины (C12-14), такие как POL являются слабыми солюбилизаторами (растворителями) биологических мембран.
Способность молекул поверхностно-активного вещества, пенетрировать липидный бислой мембраны зависит от ионной природы молекулы. Важно отметить, что детергенты, такие как POL, быстро транспортируются через мембрану вовнутрь по механизму флип-флоп. Это связано с их не-ионной природой и гидрофильно-гидрофобными свойствами полиоксиэтиленовых цепей. Напротив, ПАВ, с выраженными гидрофильными свойствами головок, такие как STS, медленно транспортируются через мембрану, что приводит к отсроченной солюбилизации. STS растворяет мембрану напрямую выдергивая фосфолипиды с образованием покрытых детергентом мицелл, в то время как POL в большей степени образует тороидальные структуры (пончики).
Взаимодействие склерозантов с мембранами тромбоцитов
Склерозанты в низких концентрациях могут непосредственно активировать тромбоциты в отсутствие каких-либо других агонистов. Это происходит путем экспозиции фосфолипидов по механизму флип-флоп на экзоплазматической поверхности мембран. Экспозиция фосфолипидов всегда сопровождает активацию клеток и апоптоз. Фосфолипиды образуют отрицательно заряженную поверхность, которая запускает и поддерживает каскад свертывающей системы крови. В результате активируются фосфолипид-индуцированные коагуляционные комплексы, такие как теназа и протромбиназа. Если на поверхности мембраны нет фосфолипидов, коагуляцинные реакции проходят очень медленно, поэтому клетки в состоянии покоя по существу не способны поддерживать коагуляционный каскад.
Склерозанты активируют как тромбоциты так и прокоагулянтные плазматические факторы с образованием фибриновых тромбов. Это подтверждается в экспериментах in vitro и клинически. STS и POL в низких концентрациях вызывают тромбоз. После введения склерозантов в форме пены, прокоагулянтная активность возрастает как целевом сегменте вены, так и на довольно большом расстоянии от нее, в том числе и в глубоких венах. Склерозанты способны активировать тромбоциты даже в очень небольших концентрациях. При таких низких концентрациях, склерозанты не могут лизировать клеточную мембрану, однако, высвобождают цитозольный кальций, вызывают экспозициюю фосфолипидов и высвобождение в экзоплазму активированных тромбоцитарных микрочастиц (platelet-derived microparticles - РМР). Микрочастицы, высвобождаемые под воздействием склерозантов, обладают прокоагулянтной активностью и могут вызвать системные тромбоэмболические осложнения после склеротерапии.
В отличие от эффектов, наблюдаемых при низких концентрациях, в высоких концетрациях оба агента лизируют эндотелиоциты, тромбоциты и другие клетки, циркулирующие в крови. Кроме того, STS в высоких концетрациях денатурирует и инактивирует белки, в частности плазменные факторы свертывания. Это обусловлено анионной природой этих детергентов, нарушающих пространственную структуру белков-мишеней. И действительно, ФИБРО ВЕЙН пролонгирует большинство тестов на тромбообразование, и в высоких концентрациях предотвращает образование тромбов. POL, будучи детергентом не-ионного происхождения, в высоких концентрациях может лизировать тромбоциты, но не разрушает факторы свертывания плазмы.
Заключение
Поверхностно-активные вещества имеют поразительное сходство с молекулами фосфолипидов клеточныхмембран. Эти агенты демонстрируют замечательную универсальность при взаимодействии с клеточными мембранами, начиная от активации и заканчивая полным лизисом. Взаимодействие склерозантов с клеточными мембранами зависит от концентрации, молекулярной структуры, ионных свойств, а также от рН и химической природы растворителя (например, физиологического раствора или воды). Кроме того, в зависимости от ионной природы молекулы склерозантов могут взаимодействовать с белками плазмы и клеточных мембран. Физико-химические свойства склерозантов определяют исход биохимических взаимодействий и могут влиять на клинический результат.